- Зохиолч Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:28.
- Хамгийн сүүлд өөрчлөгдсөн 2025-01-23 12:27.
Шингэрүүлэлт нь төвлөрсөн уусмалыг илүү шингэрүүлсэн болгох үйл явц юм. Хэн нэгэн шингэрүүлэлт хийхийг хүсч болох ноцтой шалтгаануудаас эхлээд янз бүрийн шалтгаанууд байдаг. Жишээлбэл, биохимичүүд уусмалыг төвлөрсөн хэлбэрээс нь шингэлж туршилтанд ашиглах шинэ шийдэл гаргадаг бол нөгөө талаас барменууд коктейлийг илүү амттай болгохын тулд согтууруулах ундааг зөөлөн ундаа эсвэл жүүсээр шингэлдэг. Шингэрүүлэлтийг тооцоолох ерөнхий томъёо нь C1V1 = C2V2, C -тэй1 болон C.2 уусмалын анхны ба эцсийн концентрацийг тус тус илэрхийлж, В.1 болон В.2 эзлэхүүнийг илэрхийлнэ.
Алхам
2 -р арга 1: Шингэрүүлэлтийн тэгшитгэлээр баяжмалыг нарийвчлан шингэлнэ

Алхам 1. Мэдэж, мэдэхгүй байгаа зүйлээ тодорхойл
Химийн шингэрүүлэлт гэдэг нь ихэвчлэн түүний концентрацийг мэддэг бага хэмжээний уусмал авч дараа нь төвийг сахисан шингэн (ус гэх мэт) нэмж, илүү том хэмжээтэй боловч бага концентрацтай шинэ уусмал гаргахыг хэлдэг. Үүнийг химийн лабораторид ихэвчлэн хийдэг, учир нь үр дүнтэй байхын тулд урвалжийг ихэвчлэн маш өндөр концентрацид хадгалдаг бөгөөд дараа нь туршилтанд ашиглах зорилгоор шингэлдэг. Ерөнхийдөө ихэнх бодит нөхцөл байдалд та анхны уусмалынхаа концентраци, эцсийн концентрацийг хүсч буй концентраци эсвэл эзэлхүүнийг мэдэх болно, гэхдээ эцсийн шийдлийг олж авахад шаардагдах анхны уусмалын хэмжээг мэдэхгүй байх болно.
- Гэсэн хэдий ч бусад нөхцөл байдалд (ялангуяа сургуулийн асуудалтай тулгарвал) тааврын бусад хэсгүүдийг олох шаардлагатай болж магадгүй юм. Тухайлбал, танд анхны эзлэхүүн, концентрацийг өгч, хэрэв та уусмалыг шингэлвэл эцсийн концентрацийг олохыг хүсч болно. хүссэн эзлэхүүн рүү. Шингэрүүлсэн ямар ч тохиолдолд эхлэхээс өмнө мэдэгдэж байгаа болон үл мэдэгдэх хувьсагчдыг тэмдэглэх нь зүйтэй.
-
Жишээ асуултуудыг дуусгая. 5 М -ийн уусмалыг усаар шингэлж 1 литр уусмал авахыг биднээс хүссэн гэж бодъё мм. Энэ тохиолдолд бид анхны уусмалынхаа концентраци, хүссэн хэмжээ, эцсийн концентрацийг мэддэг боловч хүссэн үр дүнд хүрэхийн тулд усаар уусгах шаардлагатай уусмалын хэмжээг мэддэггүй.
Санамж: Химийн хувьд М нь молярит гэж нэрлэгддэг концентрацийн хэмжилт бөгөөд энэ нь нэг литрт агуулагдах бодисын молийг илэрхийлдэг
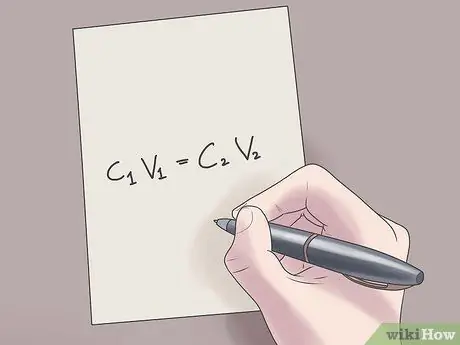
Алхам 2. Өөрийн үнэлэмжийг C томъёонд оруулна уу1V1 = C2V2.
Энэ томъёонд C.1 Энэ бол уусмалын анхны концентраци, V1 нь анхны уусмалын эзэлхүүн, С2 нь уусмалын эцсийн концентраци бөгөөд В.2 нь эцсийн шийдлийн эзлэхүүн юм. Мэдэгдэж буй утгыг энэ тэгшитгэлд оруулснаар үл мэдэгдэх утгыг олоход бэрхшээл багатай болно.
- Үүнийг шийдвэрлэхэд туслахын тулд хайж буй нэгжийнхээ өмнө асуултын тэмдэг тавих нь танд тустай байж магадгүй юм.
-
Жишээгээ үргэлжлүүлье. Бид мэддэг утгуудаа дараах байдлаар оруулна.
- C1V1 = C2V2
- (5м) В.1 = (1 мм) (1 л). Манай хоёр концентраци өөр өөр нэгжтэй. Энд зогсоод дараагийн алхам руугаа явцгаая.

Алхам 3. Аливаа нэгжийн ялгааг анхаарч үзээрэй
Шийдэл нь концентрацийн өөрчлөлтийг агуулдаг (энэ нь заримдаа нэлээд том байж болно), таны тэгшитгэл дэх хоёр хувьсагч өөр өөр нэгжтэй байх нь ердийн зүйл биш юм. Үүнийг үл тоомсорлоход хялбар боловч таны тэгшитгэл дэх тэгш бус нэгжүүд нь таны хариултыг буруу болгож болзошгүй юм. Дуусгахаасаа өмнө бүх утгыг өөр өөр концентраци ба/эсвэл эзлэхүүний нэгжээр хөрвүүлнэ.
-
Бидний жишээн дээр бид M (моляр) ба мм (миллимоляр) концентрацид өөр өөр нэгжийг ашигладаг. Хоёр дахь хэмжүүрээ M болгож өөрчилье.
- 1мм × 1м/1000мм
- = 0.001 сая

Алхам 4. Дуусгах
Бүх нэгж тэнцүү болсны дараа тэгшитгэлээ шийдээрэй. Үүнийг бараг үргэлж энгийн алгебр ашиглан хийж болно.
-
Бид жишээ асуудлаа энд зогсоов: (5 M) V1 = (1 мм) (1 л). V -ийн үнэ цэнийг олж мэдье1 манай шинэ нэгжтэй.
- (5м) В.1 = (0.001 М) (1 л)
- V1 = (0.001 M) (1 L)/(5 M).
-
V1 = 0.0002 л буюу 0.2 мл байна.

Алхам 5. Хариултаа хэрхэн зөв ашиглахаа ойлгоорой
Алдагдсан үнэ цэнээ олсон гэж бодъё, гэхдээ та хийх ёстой бодит шингэрүүлэлтийн хувьд энэ шинэ мэдээллийг хэрхэн ашиглахаа мэдэхгүй байна. Энэ нь ойлгомжтой - математик, шинжлэх ухааны хэл нь заримдаа бодит ертөнцтэй таардаггүй. C тэгшитгэл дэх дөрвөн утгыг мэдэх үед1V1 = C2V2, шингэрүүлэлтийг дараах байдлаар хийнэ.
- V эзлэхүүнийг хэмжинэ1 С концентрацитай уусмалаас1. Дараа нь нийт эзэлхүүнийг V болгохын тулд хангалттай шингэрүүлэгч (ус гэх мэт) нэмнэ2. Энэхүү шинэ шийдэл нь таны хүссэн концентрацийг авах болно (C2).
- Жишээлбэл, бид эхлээд 5 мл уусмалын 0.2 мл -ийг хэмжиж, дараа нь уусмалын хэмжээг 1 л: 1 л - 0.0002 л = 0.9998 л, эсвэл 999, 8 мл хүртэл нэмэгдүүлэхийн тулд хангалттай хэмжээний ус нэмнэ.. Өөрөөр хэлбэл бид жижиг дээжийн уусмалдаа 999.8 мл ус нэмнэ. Манай шинэ шингэрүүлсэн уусмал нь 1мМ концентрацитай бөгөөд энэ нь бидний хүссэн концентраци юм.
2 -ийн 2 -р арга: шингэрүүлэлтийн энгийн бөгөөд практик шийдэл гаргах

Алхам 1. Мэдээлэл авахын тулд ямар ч сав баглаа боодол уншина уу
Та гэртээ, гал тогоонд эсвэл химийн бус бусад лабораторид шингэрүүлэх уусмал хийхийг хүсч болох олон шалтгаан бий. Жишээлбэл, энгийн баяжмалаас жүржийн шүүс хийх нь шингэрүүлэлт юм. Ихэнх тохиолдолд шингэлэх шаардлагатай бүтээгдэхүүн нь савлагааны хаа нэгтээ хийх ёстой шингэрүүлэлтийн талаархи мэдээллийг агуулдаг. Тэд дагаж мөрдөх нарийн заавартай байж магадгүй юм. Мэдээлэл хайхдаа дараах зүйлсийг анхаарах хэрэгтэй.
- Ашигласан бүтээгдэхүүний хэмжээ
- Ашигласан шингэрүүлэгчийн хэмжээ
- Ашигласан шингэрүүлэгчийн төрөл (ихэвчлэн ус)
- Холих тусгай заавар
- Хэрэглэсэн шингэний яг концентрацийн талаарх мэдээллийг та харахгүй байж магадгүй юм. Энэ мэдээлэл нь энгийн хэрэглэгчдэд ашиггүй болно.

Алхам 2. Төвлөрсөн уусмалд шингэрүүлэгчийн үүрэг гүйцэтгэдэг бодисыг нэмнэ
Гэрийн энгийн шингэрүүлэлтийн хувьд, гал тогооны өрөөнд хийж болох шиг, та эхлэхээсээ өмнө хэрэглэж буй баяжмалын хэмжээ, ойролцоогоор эцсийн концентрацийг мэдэх хэрэгтэй. Баяжмалыг зохих хэмжээгээр шингэлэгчээр шингэлнэ. Доороос үзнэ үү.
- Жишээлбэл, хэрэв бид 1 аяга жүржийн шүүсийн баяжмалыг анхны концентрацийн 1/4 хүртэл шингэлэхийг хүсч байвал бид нэмж өгөх болно 3 аяга баяжмал руу ус хийнэ. Бидний эцсийн хольц нь 4 аяга бүхэлд нь 1 аяга баяжмал байх болно - анхны концентрацийн 1/4.
- Илүү төвөгтэй жишээ энд байна: Хэрэв бид 2/3 аяга баяжмалыг анхны концентрацийн 1/4 болгон шингэлүүлэхийг хүсч байвал 2/3 аяга нь 2 ба 2/3 аяганы 1/4 хэмжээтэй тэнцэх тул 2 аяга ус нэмнэ. бүхэл бүтэн шингэн.
- Том хэмжээний аяга эсвэл үүнтэй төстэй савыг хүссэн эцсийн эзлэхүүнийг хадгалах хангалттай хэмжээтэй саванд өөрийн бодисыг нэмж оруулахаа мартуузай.

Алхам 3. Ихэнх тохиолдолд нунтаг эзэлхүүнийг үл тоомсорлодог
Шингэн дээр нунтаг (зарим ундааны холимог гэх мэт) нэмэх нь ихэвчлэн шингэрүүлэлт гэж тооцогддоггүй. Шингэн дээр бага хэмжээний нунтаг нэмснээс үүссэн эзлэхүүний өөрчлөлт нь ихэвчлэн бага хэмжээтэй байдаг. Өөрөөр хэлбэл, шингэн дээр бага хэмжээний нунтаг нэмж оруулахдаа хүссэн эцсийн шингэн дээрээ нунтаг нэмээд холино.
Анхааруулга
- Үйлдвэрлэгчээс өгсөн эсвэл танай компаниас шаардсан аюулгүй ажиллагааны удирдамжийг дагаж мөрдөөрэй. Хэрэв та хүчиллэг уусмалыг шингэлэх шаардлагатай бол энэ нь ялангуяа чухал юм.
- Хүчиллэг уусмалтай ажиллах нь хүчиллэг бус уусмалаас илүү аюулгүй байдлын нарийвчилсан арга хэмжээ, удирдамж шаарддаг.






